CEIm
El Comité Ético de Investigación con Medicamentos (CEIm) del Área de Salud de Salamanca es el que se encarga de evaluar y supervisar los ensayos clínicos, los estudios observacionales y otros estudios de investigación biomédica en atención primaria y atención especializada, todo ello desde el Complejo Asistencial Universitario de Salamanca. En el IBSAL estas funciones se aplican a los estudios en humanos.
¿Cuál es su función?
La función principal del CEIm es informar si un estudio biomédico es idóneo o no desde el punto de vista ético, metodológico y legal. Esta evaluación se realiza antes del inicio del estudio, para poder aprobar su puesta en marcha, y a lo largo de su transcurso.
Este comité se acreditó como CEIm por la Junta de Castilla y León el 29 de enero de 2018, de acuerdo con el “Real Decreto 1090/2015, de 4 de diciembre, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos”. Su última reacreditación se aprobó el 18 de abril de 2024.
Además, está adherido al Memorando de Colaboración e Intercambio de Información entre la Agencia Española de Medicamentos y Productos Sanitarios y los Comités de Ética de la Investigación con Medicamentos.
Modelos CEIM 2025
- Carta de Compromiso del Tutor
- Carta de Presentación TFG TFM TFR Tesis
- Compromiso Confidencialidad Alumnos
- Compromiso IP Sobre DPD Otras Instituciones
- Exención de Consentimiento Informado
- Modelo Conformidad Dirección
- Modelo Conformidad Jefe de Servicio Estudios Observacionales con Medicamento
- Modelo Consentimiento Casos Clínicos
- Modelo de Compromiso del Investigador EO
- Modelo de Compromiso del Investigador PI
- Modelo Declaración Conflicto Intereses IP
- Ciclo de Vida Datos Personales
- Protección de Datos en HIP-CI
Requisitos CEIM 2024
- Requisitos Cesión y Transferencia de Muestras
- Requisitos Ensayo Clínico
- Requisitos Ensayo Clínico - CTIS
- Requisitos Ensayo Clínico Modificacion Sustancial - CTIS
- Requisitos Ensayo Clínico Modificacion Sustancial
- Requisitos Estudio Dictamen Favorable
- Requisitos EO Dictamen Favorable
- Requisitos EO Modificacion Sustancial Dictamen Favorable
- Requisitos EO Modificacion Sustancial
- Requisitos Estudio Observacional
- Requisitos Investigaciones con Productos Sanitarios
- Requisitos Investigacion Clínica Con Producto Sanitario
- Requisitos MS Investigacion Clínica Con Producto Sanitario Anterior RD 192
- Requisitos MS Investigacion Clínica Con Producto Sanitario RD 192 2023
- Requisitos Proyectos de Investigación
- Requisitos PI Dictamen Favorable
- Requisitos PI Modificacion Sustancial
- Requisitos TFG TFM TFR Tesis

Preguntas frecuentes
¿Cuándo debo presentar un estudio?
Los proyectos de investigación se tienen que enviar al CEIm para su evaluación antes de su realización. Un proyecto de investigación no puede iniciarse sin el correspondiente dictamen favorable del CEIm.
El CEIm no evaluará proyectos que ya se hayan realizado.
¿Cómo debo presentar la documentación o notificaciones al CEIm?
Todas las notificaciones y documentos se deben enviar exclusivamente en formato digital (artículo 14.3 de la ley 39/2015 de 1 de octubre) por correo electrónico a la dirección del comité (comite.etico.husa@saludcastillayleon.es) o a Ensayos Clínicos con Medicamentos, a través de la plataforma europea de Ensayos Clínicos (CTIS).
No se aceptará ninguna documentación presentada en papel (Acta 2021/04).
¿Qué documentación debo presentar para mi estudio?
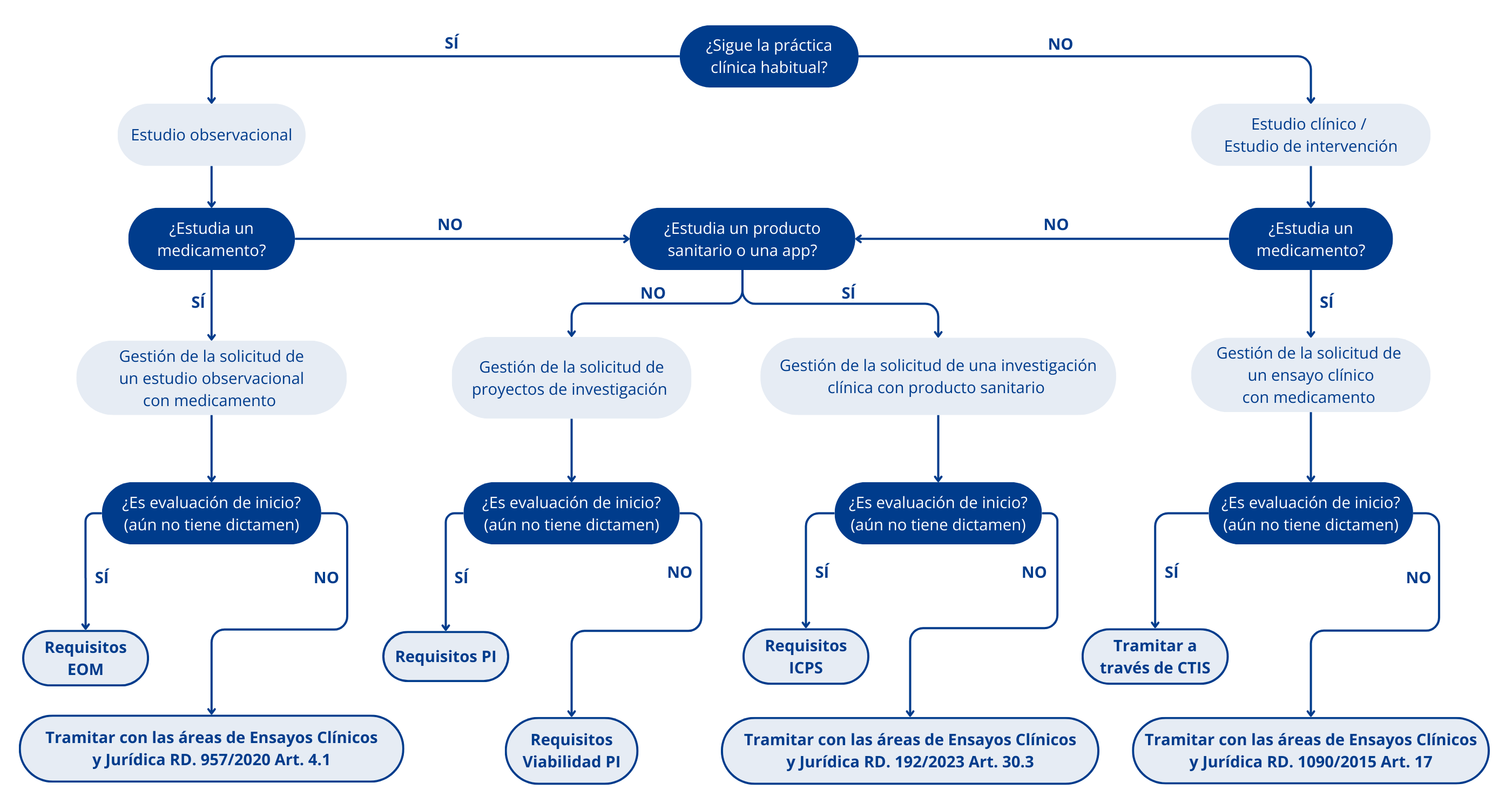
En la sección de requisitos de esta página se pueden encontrar los documentos a presentar según el tipo de estudio (ver diagrma de la sección superior)
¿Es necesario añadir en la HIP el contacto para el IP local?
La hoja de información al participante (HIP) debe incluir el contacto del investigador principal (nombre y teléfono) para poder ponerse en contacto con él en caso de dudas.
En estudios multicéntricos (o con vistas de serlo) lo ideal es dejar un espacio para que se añada el centro, el investigador principal y el teléfono de contacto correspondiente.
¿Con quién debo gestionar el contrato de un estudio de investigación clínico?
Para llevar a cabo el estudio en nuestra Área de Salud necesita ponerse en contacto con los servicios jurídicos del Hospital Universitario de Salamanca (juridica.husa@saludcastillayleon.es) y con el Instituto de Investigación Biomédica de Salamanca (ensayosclinicos@ibsal.es) para concretar los aspectos legales y contractuales.
¿Cómo saber la clasificación de mi estudio y la ruta administrativa a seguir?
El árbol de decisiones de la sección sueprior puede ayudarle a seguir la vía administrativa adecuada.
¿Cómo se tramitan las tasas por evaluación de estudios?
Para presentaciones iniciales de evaluación de ensayos clínicos con medicamento como CEIm de referencia, la tasa es única para la agencia y el comité. El pago de tasas se tramitará a través de este formulario.
El abono de tasas por evaluación de estudios observacionales con medicamento o investigaciones clínicas con producto sanitario se realiza a través del modelo 046, para más información en los siguientes links:
- https://tributos.jcyl.es/web/jcyl/Tributos/es/Plantilla100/1284270178029/_/_/_
- https://tributos.jcyl.es/web/jcyl/Tributos/es/Plantilla100/1284270176021/_/_/_
La tasa tiene código identificativo:
SANIDAD, D.G. Salud pública, 306.1.0 Tasa por servicios sanitarios:
306.1.0.9: Investigación biomédica y en ciencias de la salud: Por la tramitación y gestión de actuaciones previas a la emisión de dictámenes por el Comité Ético de Investigación Clínica relativos a la realización de ensayos clínicos y estudios postautorización con medicamentos de uso humano o productos sanitarios.
¿Aceptamos dictámenes de otro CEI/CEIm de referencia?
Para ensayos clínicos con medicamento:
– Un ensayo clínico con medicamento que cuenta con el dictamen favorable de otro CEIm de referencia se encontraría al amparo del artículo 17.2.a del Real Decreto 1090/2015 de 4 de diciembre, que indica que el dictamen emitido por un CEIm de territorio nacional será único y vinculante, por tanto, no es necesaria su evaluación por parte del Comité Ético del Área de Salud de Salamanca.
Para estudios observacionales:
– Un estudio observacional con medicamento que cuenta con dictamen favorable de otro CEIm de referencia se encontraría al amparo del artículo 4.1 del R.D. 957/2020 de 3 de noviembre que indica que el dictamen emitido por un CEIm de territorio nacional será único y vinculante, por tanto, no es necesaria su evaluación por parte del Comité Ético del Área de Salud de Salamanca.
Para investigaciones clínicas con productos sanitarios:
– Un estudio de investigación clínica con producto sanitario que cuenta con el dictamen favorable de otro CEIm de referencia, se encontraría al amparo del artículo 30.3 del Real Decreto 192/2023 de 21 de Marzo que indica que el dictamen emitido por un CEIm de territorio nacional será único y vinculante, por tanto, no es necesaria su evaluación por parte del Comité Ético del Área de Salud de Salamanca.
Para proyectos de investigación:
– Para proyectos de investigación con dictamen favorable de otro CEIm de referencia se evaluarán los aspectos locales para informar de la viabilidad para la realización del estudio en nuestra área de salud.